製品に関する情報
- カタログ、資料ダウンロード
-
製品資料データ、カタログ、取扱説明書を会員サイトからダウンロードできます。
- ダウンロード方法については、こちらをご覧ください。
- ※ダウンロードをするには、会員登録が必要です。
- イワキのサポート
- よくあるご質問、各種お問い合わせ、製品メンテンナンス動画など、イワキ製品のサポートについてご紹介します。
ポンプなるほど
このコーナーでは、ポンプにまつわる様々な「専門用語」にスポットを当て、イワキ流のノウハウをたっぷり交えながら、楽しく軽やかに解説します。今まで「なんとなく」使っていた業界の方はもちろん、専門知識ゼロでもわかる楽しい用語解説を目指しています。文末の「今日の一句」にもご注目ください。クスッと笑えて記憶に刻まれるよう、毎回魂を注いで作っております。
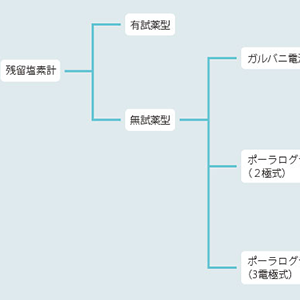
前回は残留塩素計の「全体像」をお見せしました。復習のため、もう一度、見てみましょう。
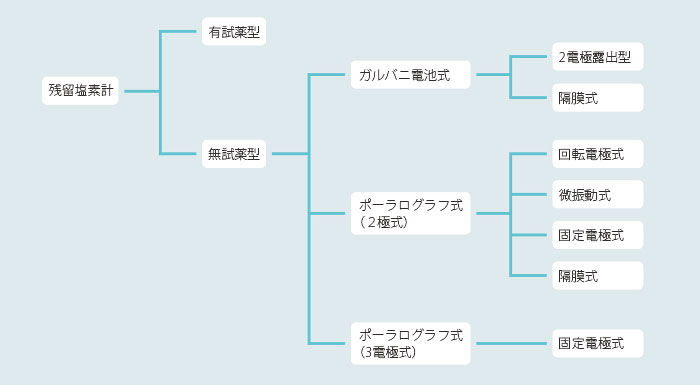
ご覧の通り、無試薬型の残留塩素計には「ガルバニ電池式」と「ポーラログラフ式」があります。
現在の主流はポーラログラフ式ですが、ちょっと変わった名前の「ガルバ二電池」も気になりますよね。3つの違いをサクッというと、こんな感じになります。
・ガルバ二式
2種(白金と銅など)の異なる金属を利用し両電極間に電圧を印加しない方式を指します。ポーラログラフ式に比べ、構造は簡単ですが水質の影響を受けやすい欠点があります。
・ポ—ラログラフ式(2電極)
2種(金と銀塩化銀電極)の貴金属間に所定の電圧を印加する方式を指します。残留塩素の還元反応電流を取りやすい電位を選んで印加することで、電極の状態を定常化し、より水質影響や直線性などに優れた測定方法になります。残留塩素との反応で、対極(対電極)の銀塩化銀電極が徐々に溶出するため、作用極(作用電極)上にメッキされてしまい測定の障害となるため、装置上電極配置などの工夫が必要です。
・ポ—ラログラフ式(3電極)
2電極式を改良したもので、3種の貴金属間に所定の電圧を印加する方式を指します。塩素の還元反応を起こす「作用極(作用電極)」、電圧を印加するための基準電位となる「基準極(比較電極)」(銀塩化銀電極)に加え、作用極上で起こる塩素の還元反応と等価な酸化反応を起こす「対極(対電極)」で構成され、2電極式のような銀塩化銀電極の溶出は起こらないため、電極の小型化が可能となります。
ポンプなるほど こぼれ話 -ガルバ二電池(ボルタ電池)-
ちょっと変わった名前のガルバ二電池。「ガルバ二、ガルバ二」と、何度も続けて言っていると、
「あれ?こんな感じのスポーツ、確かあったような・・・?」と、ふと脳裏をよぎりましたが、あれは「カバディ」。全然似ていませんでした。
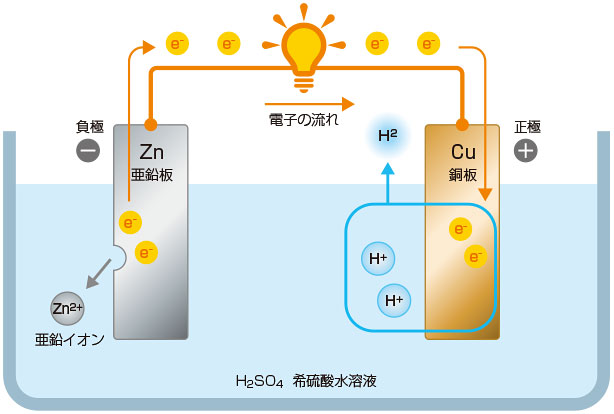
さて、ガルバニ電池の説明に入る前に、「電池そもそも」をちょこっとお話しますと、イタリアのお医者さんで解剖学者の「ルイージ・ガルヴァーニさん」が、死んだカエルの足に電気を通すと、ピクピクと筋肉が反応することを発見しました。小学生の理科の実験でやりましたよね。おおっ!なぜ動くんだぁ〜?! と衝撃を受けたかどうは存じ上げませんが、そこから電池の研究が始まったと言われています。ガルバニって人の名前だったんですね。
ガルヴァーニさんは「動物の筋肉に電気が蓄えられているにちがいない」と考えて研究を重ねていきましたが、「そんなことねんじゃね?」と言ったかどうかは知りませんが、イタリアの物理学者の「アレッサンドロ・ボルタさん」が、ガルヴァーニさんの実験をさらに追求した結果、銅とスズと食塩水を使った電池の発明に成功しました。電流は筋肉ではなく、金属の組み合わせによって作り出せることを証明したのです。これが1800年に誕生した「ボルタ電池」です。今も電圧の単位は「ボルト」で表しますが、ボルタさんの名前から来ているんですね。ガルバ二電池もボルトも、世紀の大発明をした方に敬意を評して名前を使うその心意気、素敵だなぁと思います。
では本日の主役「ポーラログラフ」の登場です。
JISによると、「滴下水銀電極を作用極にした電気分解において、作用極の電位と電流の関係を測定する分析方法」と定義されていますが、現在では水銀電極を用いなくても、このような方法で測定することをポーラログラフと呼んでいます。
まずはこちらの図をご覧ください。
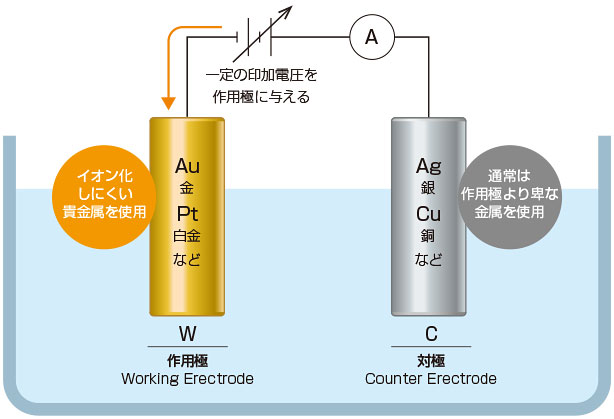
作用極(W極)には金(Au)、白金(プラチナ Pt)などを、対極(C極)には銀(Ag)などを用いるのが一般的です。残留塩素があると、作用極表面では、塩素が電子をもらい、活性のない「塩化物イオン」に還元され、一方の対極では、銀が電子を離して「銀イオン」に酸化されます。
少し詳しくなりますが、ポーラログラフ式残留塩素計の肝である電極にかける電位(印可電圧)について説明します。
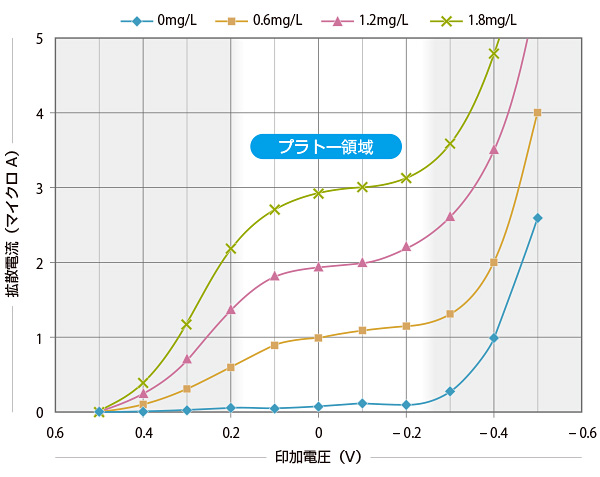
2つの電極間に電圧を印加させ、電極間に流れる電流をみたときに、電圧を変化させていったときの電圧と電流の関係をグラフにしたものが「ポーラログラフ波」と呼ばれる下記の電圧電流曲線のグラフとなり、流れる電流を「拡散電流」と呼びます。
グラフにおいて、残留塩素濃度が異なる4種のサンプルそれぞれの電流値が比較的平坦になる(変化が少なくなる)領域があらわれる現象をプラトー特性といいます。このプラトー領域の電位においては残留塩素濃度と拡散電流に比例関係が成り立ちます。このプラトー特性の表れる電位を作用電極に対して印加した直線性再現性に優れた測定方法をポーラログラフ式残留塩素計と呼んでいます。
【作用極の還元反応】
Cl2 + 2e– → 2Cl–
HClO + H+ + 2e– → H2O + Cl–
CLO– + 2H+ + 2e– → H2O + Cl–
【対極の酸化反応】
Ag → Ag+ + e–
かたや電子を失い、かたや電子をもらう。この電子のやりとりが行われるため、作用極と対極の間には電流が流れます。ここまではすんなり理解できると思いますが、「ん? この酸化還元現象で、なんで塩素濃度がわかるの?」と、思ったあなたは鋭い!!
おっしゃる通り、ポーラログラフ方式では、残留塩素濃度が直接わかるわけではありませんが、ある電流の性質を利用して溶液の濃度を識別しています。それは、「残留塩素濃度と酸化還元反応の電流は<正比例>するの法則」!
濃い溶液では電気がバンバン流れ、薄いとちょっとしか電気が流れなくなります。この電流の強弱と濃度に置き換えて、残留塩素の量を測る! これが残留塩素計の動作の原理なのです。
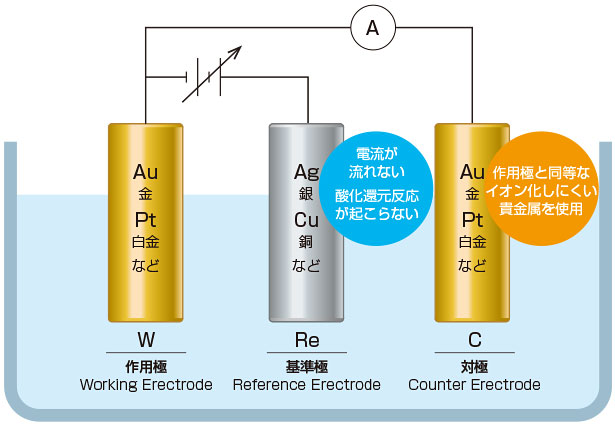
3電極式ポーラログラフは、2電極式を改良したものです。2電極式では、作用極上で起こる塩素の還元反応と等価な酸化反応が対電極(銀塩化銀電極)で起こるため、銀が電子を離して銀イオンになり徐々に溶出していき、場合によっては作用電極表面にメッキ状に吸着して測定の障害となる事があります。
3電極式では、以下の3つ電極から構成されています。
電位は基準極に対して作用極に印加しますので、基準極では酸化または還元反応は起こらないため電流が流れず、銀の溶出はありません。対極側では酸化反応が起こりますが、対極には作用極と同様のイオン化しにくい貴金属(金や白金)を使用し、水の中の溶媒溶質を使って酸化反応を起こしますので、対極の金属が溶出することはありません。(拡散電流は作用極と対極間に流れますので、2電極式のような銀の溶出はありません)
また、「ポテンショスタット」と呼ばれる常に電位を一定に保つための電位制御回路を使いますので、流れた電流や導電率変化による電圧降下がおこりません。
【作用極】
2電極式ポーラログラフと同様な還元反応
Cl2 + 2e– → 2Cl–
HClO + H+ + 2e– → H2O + Cl–
CLO– + 2H+ + 2e– → H2O + Cl–
【基準極】
作用極にかける電位の基準としてしか機能していないため、電流は流れず銀の溶出は起こらない。
【対極】
対極の材質を作用極と同質な不活性電極をしようすると、金属溶出は起こらない
そのため、電極に接している溶液を反応させるかたちになる。
2OH– → 1/2O2 + H20 + 2e–(例)
| 2電極式 | 3電極式 | |
| 作用極(W) | 塩素の還元反応 | 塩素の還元反応 |
| 対極(C) | 銀の酸化反応(銀を溶かす反応) | 水分子、酸素、水中溶質の酸化反応(対極は金や白金を使用するため解けない) |
| 基準極(Re) | なし | 基準電位極として存在。酸化還元反応がないため電流は流れない |
今日の一句
電流測れば濃度がわかる 時代の先端ポーラログラフ
残留塩素濃度計 SR-10-30A/27A/40[低濃度]

残留塩素濃度計 IR-11-30A/40/43HT/40W[低濃度]

データロガー機能搭載無試薬型残留塩素濃度計 GR-10B-220A-20C[低濃度]

極低濃度残留塩素計 ER-100L[極低濃度]

次の記事へ
前の記事へ
製品資料データ、カタログ、取扱説明書を会員サイトからダウンロードできます。
ページトップ